Un tratamiento desarrollado por un laboratorio argentino para la enfermedad de Fabry, que es poco frecuente, se encuentra en estudio de fase 3 -última de los ensayos clínicos- y de aprobarse convertirá a Argentina en el segundo país después de Japón en diseñar y producir una droga biosimilar -con base biológica y de un costo menor- para esta patología.
“La enfermedad de Fabry es una patología genética que está dentro de las poco frecuentes. A nivel mundial desde 2001 hay dos terapias de los laboratorios multinacionales de innovación; hace poco salió una droga oral que es para algunos pacientes dependiendo del gen mutado, y como biosimilar nosotros seríamos el segundo, hay sólo uno aprobado en Japón”, detalló a Télam Mario Koch, director comercial de Latam Sur de la compañía biotecnológica Biosidus, desarrolladora del tratamiento.
El ensayo clínico de fase 3 se está realizando en centros de salud de la ciudad de Buenos Aires, Quilmes, Pergamino y Córdoba y tiene como objetivo demostrar la eficacia y seguridad del producto biosimilar en 20 pacientes con Enfermedad de Fabry previamente estabilizados con el producto innovador.
La enfermedad de Fabry
En la actualidad ya se está administrando en dos pacientes y hay 10 más reclutados, a quienes hay que hacerles los estudios para verificar que cumplan los requisitos para ingresar al protocolo de investigación aprobado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat).
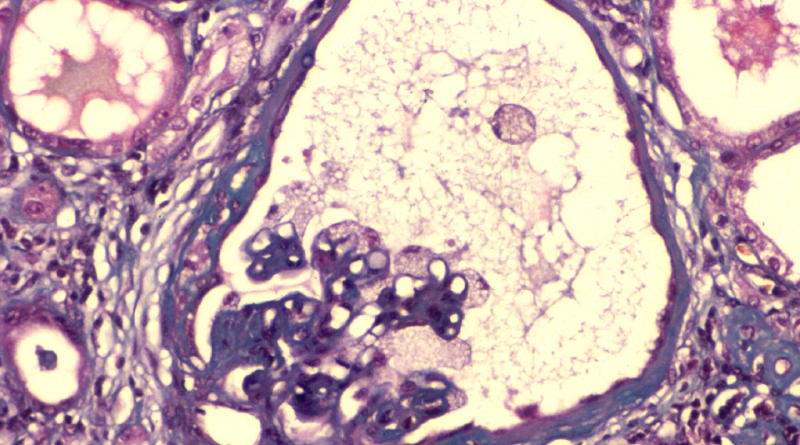
La enfermedad de Fabry tiene origen genético y afecta la capacidad del lisoma (que es una parte de las células que permite descomponer elementos que es necesario destruir), se caracteriza por manifestaciones cutáneas específicas (vasos dilatados que se ven como manchas rojas), neurológicas (dolor), renales (como insuficiencia renal crónica), cardiovasculares (miocardiopatía, arritmia), y cerebrovasculares (ataques isquémicos transitorios, accidentes cerebrovasculares).
El tratamiento desarrollado es agalsidasa beta, que consisten en sustitución enzimática para reponer la proteína alfa-galactosidasa A deficitaria y prevenir, así, el depósito intracelular de la globotriaosilceramida (una enzima que degrada grasas) en los lisosomas, y otros compartimentos celulares.
ADN recombinante
Su desarrollo se obtiene mediante tecnología de ADN recombinante, un proyecto que se inició hace unos diez años e involucra una inversión total de 20 millones de dólares.
“La fase 1 fue superada con éxito y el tratamiento tiene todas las condiciones para ser exitoso. Por las características propias de la enfermedad, el reclutamiento de pacientes tiene aristas muy complejas, pero esperamos poder terminar el estudio y tener la aprobación para fines de 2024”, explicó por su parte Guillermo Battolla, director de Recursos Humanos de Biosidus.
Battolla detalló que el tratamiento es una droga biosimilar. “Es un producto farmacéutico que tiene como característica que su sistema de producción es a partir de seres vivos (ya sean bacterias o células), con los que con un proceso se puede alcanzar una proteína que tiene el mismo efecto terapéutico que el producto innovador que se produce a través de una síntesis química”.
“Entonces, el biosimilar es un producto biológico con un efecto similar al innovador pero que puede hacerse con un costo mucho menor y eso genera en los mercados emergentes la oportunidad de acceder a terapias complejas a precios razonables”, añadió.
Battolla dio como ejemplo la hormona de crecimiento, como la que se utilizó en el tratamiento de Lionel Messi. “Un tratamiento de este tipo puede durar entre cuatro y cinco años con una toma cotidiana y eso representa un costo carísimo; nosotros tenemos un biosimilar para esto”, señaló.
El trabajo de Biosidus en las denominadas drogas huérfanas, aquellas que son para enfermedades poco frecuentes o desatendidas, será apoyado por el Estado nacional a través de diferentes mecanismos tanto por el Ministerio de Economía (a través de la Secretaría de Economía del Conocimiento) como el Ministerio de Salud, en la parte productiva y en el ensayo clínico de fase 3 en curso.
Drogas huérfanas
El pasado 1 de marzo, el presidente Alberto Fernández, en su discurso ante la Asamblea Legislativa destacó a esta compañía por su trabajo en la producción y desarrollo de drogas huérfanas y ratificó la importancia de la articulación público-privada en el ámbito de la ciencia y la salud.
En esta dirección, la empresa -que lleva 40 años produciendo biosimilares y es líder en mercados emergentes donde exporta a más de 65 países- señaló que ya están trabajando una segunda molécula para otra enfermedad poco frecuente y que el objetivo “es convertirse en un referente regional en el desarrollo y producción de este tipo de productos”.
Battolla aseguró que “el desarrollo de este tipo de drogas permitirá al Estado y al Sistema de Salud en general ahorros millonarios respecto a los tratamientos de los productos innovadores, así como el acceso a más cantidad de pacientes a un tratamiento que les brindará una mejor calidad de vida”.
“Pero en el caso de que se apruebe el tratamiento para la enfermedad de Fabry, como es el único biosimilar en la región, seguramente se exportará por lo que además de sustituir importaciones permitiría el ingreso de divisas por exportaciones”, concluyó.
Seguir leyendo:
Avanzan en la producción de medicamentos para enfermedades poco frecuentes
Gaucher: La UNLP estudia tratamientos contra la poco frecuente enfermedad ósea
Acuerdo entre ministerios para fortalecer la investigación científica en Salud