El síndrome de CHARGE es un severo trastorno del neurodesarrollo caracterizado por cardiopatías, coloboma ocular, malformaciones craneofaciales, sordera e hipogonadismo. En la mayoría de los casos, se ha establecido que las causas de este síndrome están relacionadas con mutaciones en el gen Chd7, que codifica para una helicasa que regula la expresión génica.
A pesar de la importancia para la salud pública de este trastorno cognitivo, poco se conoce sobre la función de Chd7 en la patología de CHARGE. Esto se debe, en parte, a que, dada la enorme cantidad de genes regulados por Chd7, no resulta sencillo poder determinar la identidad de los genes que al desregularse llevan al desarrollo del trastorno.
Un reciente trabajo de científicos y científicas del CONICET, liderado por Daniel Hochbaum, investigador del Departamento de Biodiversidad y Biología Experimental de la Facultad de Ciencias Exactas y Naturales de la Universidad de Buenos Aires (DBBE, UBA), sugiere que Chd7 se vincularía con el síndrome de CHARGE a través de su rol en la regulación de la vía de señalización de TGF–β, responsable en parte de la síntesis de la matriz extracelular, una estructura que le da soporte a las células. Los resultados del estudio fueron publicados en la revista Proceedings of the National Academy of Sciences (PNAS).
Los roles de chd-7 en C. elegans
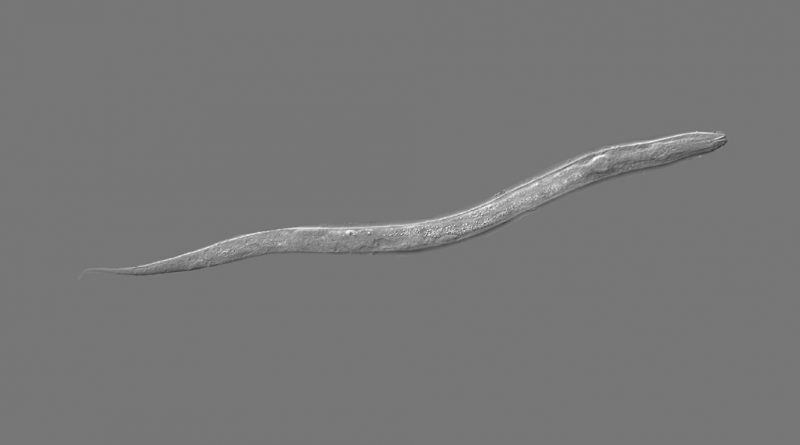
El nematodo Caenorhabditis elegans es uno de los organismos modelo más versátiles para estudiar vías moleculares implicadas en enfermedades genéticas humanas, ya que muchos genes asociados a patologías se conservan entre gusanos y humanos. En condiciones ambientales adversas, tales como alta temperatura, hacinamiento o falta de alimento, estos nematodos pueden interrumpir su desarrollo para formar la larva dauer, un estadio larval que le da al gusano la posibilidad de sobrevivir en ambientes cambiantes, así como la capacidad de dispersarse hasta encontrar condiciones ambientales favorables que le permitan retomar el desarrollo reproductivo.
En un estudio con diferentes mutantes de C. elegans modificadas genéticamente para formar dauers independientemente de las condiciones ambientales, el equipo dirigido por Hochbaum encontró que al anularse la expresión del gen chd-7 -que es similar a CHD7 y a CHD8 humanos-, las larvas no lograban formar dauers correctamente.
“Es decir, descubrimos que el gen chd-7, que en humanos está relacionado con síndromes del neurodesarrollo, en C. elegans es estrictamente necesario para la formación de dauers”, afirma Hochbaum.
Una vez que pudieron correlacionar la formación de dauer con el gen chd-7, el equipo de investigación se propuso entender a través de qué vías celulares se producía este vínculo.
“Básicamente, hay dos vías de señalización que convergen en la formación de dauers, una es la vía de la insulina y la otra es la vía TGF–β. Al cruzar animales mutantes para estas vías de señalización con gusanos que no expresan esta helicasa, encontramos que chd-7 está involucrado en la regulación de la vía TGF–β”, explica Martín Jofré, becario doctoral del CONICET en el DBBE y primer autor del artículo.
Adicionalmente, el equipo de investigación encontró que la anulación del gen chd-7 también afecta la formación de la cutícula protectora externa que tienen los gusanos C. elegans, compuesta principalmente por colágenos, dependiente de la vía TGF–β.
“Esto nos llevó a pensar que lo que veíamos en C. elegans podía tener algún correlato en vertebrados, donde la vía TGF–β -que se encuentra muy conservada- modula la llamada matriz extracelular. Las células no flotan libremente, sino que se encuentran inmersas en una matriz compuesta por colágenos, enzimas, glicoproteínas y otros compuestos. El rol de la vía TGF–β en vertebrados en la modulación de la matriz extracelular es equivalente al papel que tiene en C. elegans en la síntesis de la cutícula. Entonces, quisimos ver qué ocurría en un animal vertebrado cuando inhibíamos la expresión de Chd7”, explica Hochbuam.
El rol de Chd7 en vertebrados y en síndromes de neurodesarrollo
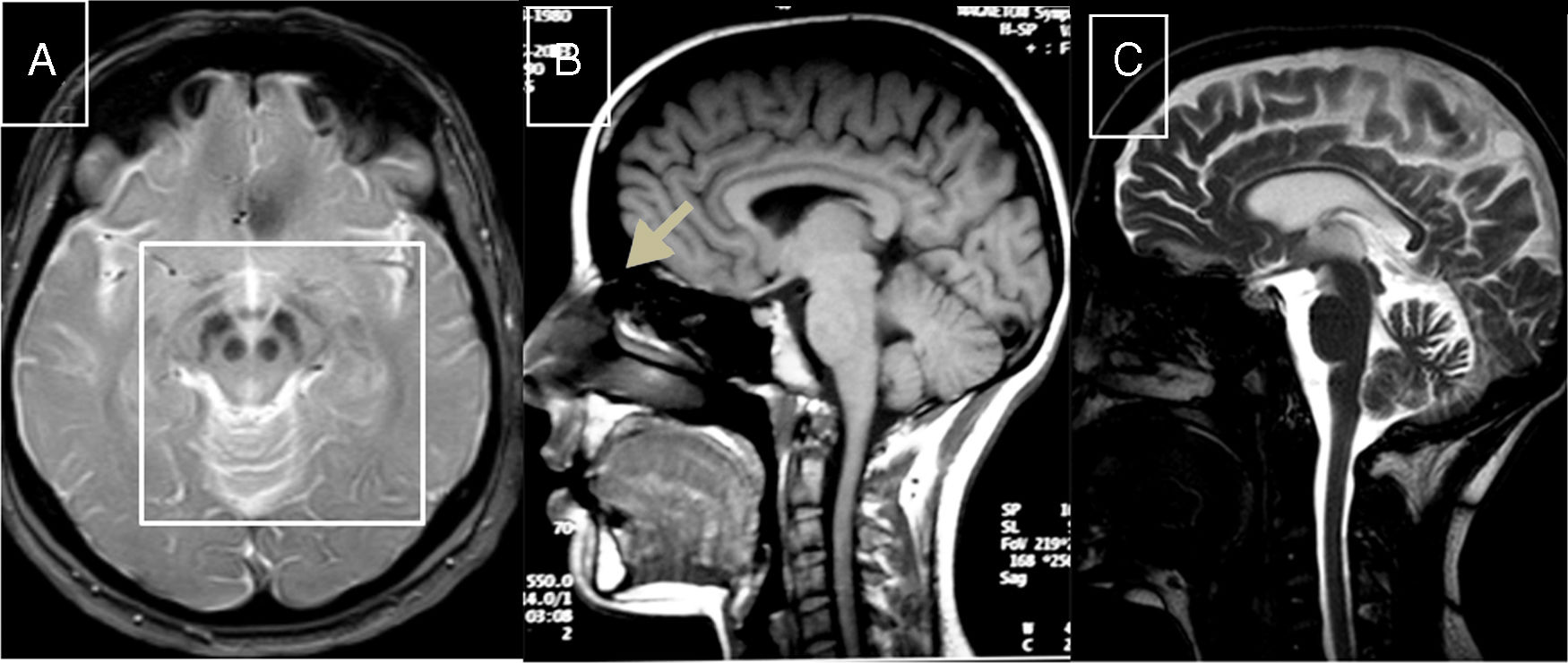
El paso siguiente fue ver que qué sucedía en Xenopus laevis, una rana que se utiliza para el estudio del desarrollo y que ha sido funcional al estudio del desarrollo cráneofacial, cuando se disminuía la expresión del gen Chd7.
“Lo que observamos es que cuando los embriones de Xenopus carecen del gen Chd7, efectivamente, aparecen problemas relacionados con la modulación de la matriz extracelular, que se manifiestan, por ejemplo, en malformaciones craneofaciales, como una disminución del tamaño de los ojos o el acortamiento de la distancia entre los mismos; fenotipos que muchas veces se ven en pacientes con CHARGE”, comenta el investigador.
Al avanzar en el estudio, el equipo de científicos y científicas logró correlacionar los problemas craneofaciales que aparecen en los modelos de Xenopus sin chd7 con una reducción significativa en los niveles de un colágeno conocido como col2a1, cuya expresión depende directamente de la señalización de TGF-β. Los ensayos con Xenopus fueron realizados por Ailen Cervino, becaria doctoral del CONICET en el Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE, CONICET-UBA), bajo la dirección de Cecilia Cirio, investigadora del Consejo en el mismo instituto.
Finalmente, los investigadores administraron exógenamente col2a1 a los embriones sin Chd7 y pudieron comprobar que de este modo bajaba la letalidad de los renacuajos de Xenopus y se corregían parcialmente los defectos craneofaciales.
“Los resultados del estudio nos sugieren que hay funciones de Chd7 en la regulación de la vía TGF–β que se conservaron de gusanos a vertebrados. Pero, además, nos provee de una posible explicación mecanística: mutaciones de Chd7 en humanos podrían estar vinculadas con la formación de una matriz extracelular defectuosa, pudiendo explicar ciertas características asociadas con el síndrome de CHARGE”, señala Hochbaum.
“Más allá de esta hipótesis, los resultados de este estudio señalan la importancia de los organismos modelo como gusanos y ranas para estudiar síndromes del neurodesarrollo asociados a Chd7 y Chd8”, concluye Jofré.
Fuente: CONICET.